研究内容
精神神経疾患の分子メカニズムの解明と創薬をめざして
精神疾患は、多くの遺伝要因と環境要因が複雑に相互作用して発症すると考えられてきていますが、その分子レベルのメカニズムは未だほとんど不明であり、薬による治療の効果も、必ずしも十分ではない疾患もあります。したがって、脳・精神機能とその病気に関する研究の社会的意義は大きく、今後も薬学の重要な研究領域となるものです。
私たちはこれまで、最新の分子生物学的研究手法を駆使し、新しい薬の標的となる分子を探索して、その機能を解明する研究に取り組んできました。今後もこの社会的に重要な研究のゴールに向かって、たえず新しい研究手法を神経薬理学研究に導入し、薬学オリジナルな発想に基づく、創薬の基礎研究を進めて行きたいと考えています。
現在、私たちが取り組んでいる研究テーマは以下の通りです:
- 脳内全細胞を可視化する新たな解析手法を用いた精神・神経疾患の新たな中間表現型探索
- ストレスによる情動障害の神経メカニズムの解明
- 発達障害の発症メカニズムの解明
- 神経ペプチドPACAPの分子薬理学的機能研究
1)脳内全細胞を可視化する新たな解析手法を用いた精神・神経疾患の新たな中間表現型探索
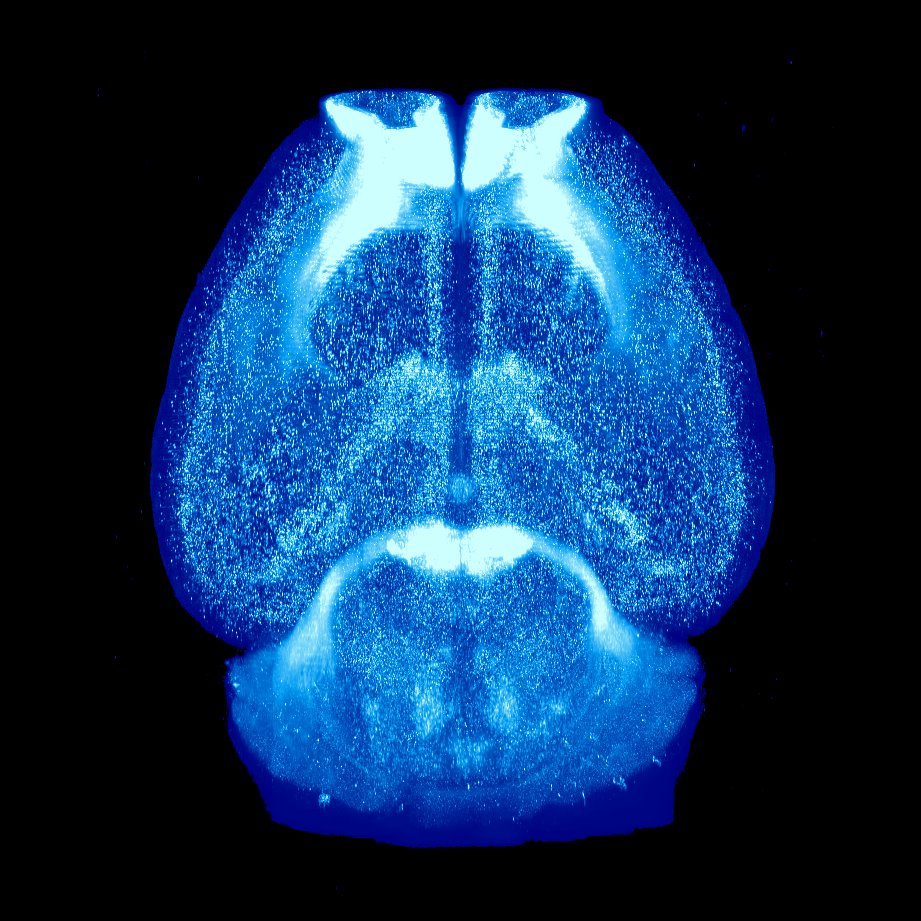
神経・精神疾患の病態解明には、脳をシステムバイオロジーとして理解する必要があるものの、その根底となる網羅的な全脳解析は、技術的な制限(画像撮影速度、全細胞の識別が困難など)によりほとんど行われていませんでした。最新のMRIでも、細胞レベルの解像度で観察することはできず、病態時に脳内でどのような変化が起きているかについては、詳しく捉えることが難しいのが現状です。そこで私たちのグループでは、詳細な脳内変化をnon-biasで検出可能かつ、細胞レベルで多群間比較を簡便に行える新たな全脳3次元形態計測システムblock-FAce Serial microscopy Tomography (FAST) を構築しました(Neuron 2017; Nature Protocols 2019)。私たちはFASTを使用して、統合失調症や自閉症モデルマウスにおける神経活動パターンの変化を全脳レベルで明らかにしました。
精神疾患の治療に用いられる薬物の中には、機序が完全には解明されていないものも多くあります。最近我々は、抗うつ作用を有するketamine光学異性体の薬効発現について、抗うつ作用の発現に重要な「前部島皮質」の活性化を見出し、社会性機能改善にも有効であることを明らかにしました(Mol Psychiatry 2024)。
 |
 |
|
| PACAP発現細胞に緑色蛍光タンパク質ZsGreenを 発現させた全脳画像の三次元再構築 |
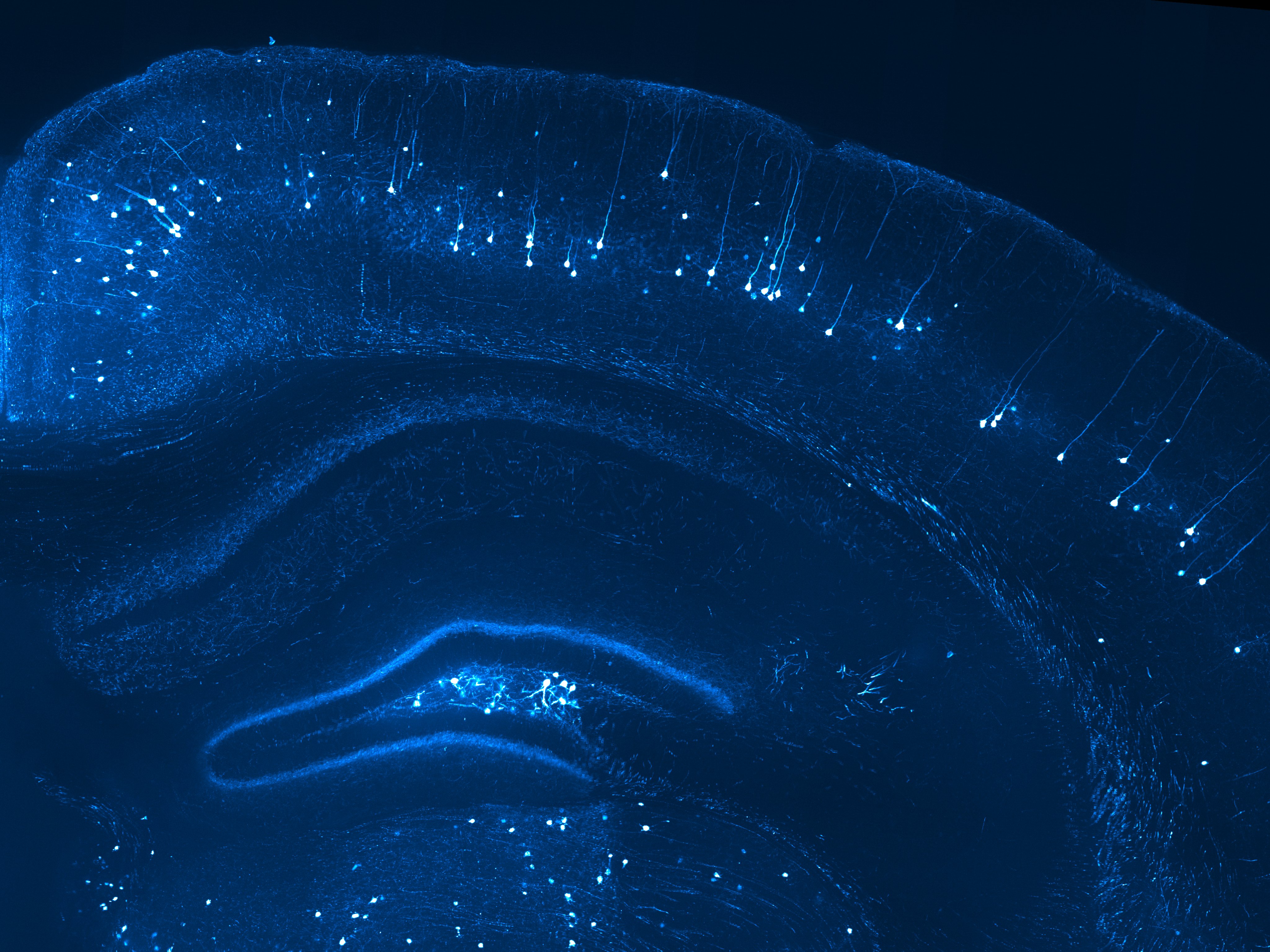
海馬周辺の局所拡大画像 |
2)ストレスによる情動障害の神経メカニズムの解明
ストレスによって引き起こされる不安や逃避行動、さらにはそれらに関連する精神疾患の発症メカニズムの解明を目指しています。この目標に向け、全脳イメージング法FAST、ウイルスベクターを用いた神経細胞標識、化学・光遺伝学的活動操作、自由行動下のカルシウムイメージングなど、最先端の脳解析技術を駆使して、どのような神経細胞集団や回路が情動行動を制御しているのかに迫ります。最近では、様々な種類のストレスを負荷した直後のマウスの脳全体における神経細胞の活動パターンを詳細に分析してきました。この研究を通じて、ストレスの種類や強度の違いが情動に与える影響を体系的に調査し、それらの違いに関連する脳領域の特定を目指しています。その一端として、ノルアドレナリン神経のごく一部の細胞集団が、社会的ストレスによる社会回避行動を制御することを明らかにしつつあります(bioRxiv, 2025)。
3)発達障害の発症メカニズムの解明
自閉スペクトラム症は、社会性やコミュニケーションの障害が主な症状ですが、その発症原因は未だ不明な点があり、主症状を緩和する治療法の開発が求められています。そこで最先端技術を用いて、発達障害モデルマウスの脳発生期の構造異常とその原因を探り、発達障害発症のメカニズムを明らかにし、これまでにない根本的な治療法の開発に繋げることを目指します。最近では、ASDや知的障害をはじめとする神経発達障害患者から同定されたde novo変異が最も多い遺伝子の1つであるPogo transposable element derived with ZNF domain (POGZ)の変異マウスを作成し、大脳皮質神経細胞の発達が低下することを見出しました (Nature communications 2020)。このマウスを用いて、行動薬理学的な解析を進めています。
4)神経ペプチドPACAPの分子薬理学的機能研究
PACAP(pituitary adenylate cyclase-activating polypeptide,下垂体アデニル酸シクラーゼ活性化ポリペプチド)は、1989年に下垂体のアデニル酸シクラーゼを活性化する作用を指標に、ヒツジ視床下部から単離された神経ペプチドであり、神経伝達物質・調節因子としての働きや、神経栄養因子様の作用など、多機能を持つことが大きな特徴です。当分野の橋本らは、1993年にPACAPに選択的な受容体PAC1の初のクローニングに成功し(Neuron 1993)、組織分布の解析によって、とくに脳に多く発現していることが分かったことから、その働きに興味を持ちました。そこで、遺伝子の詳細な発現分布や発現調節、細胞生理学的な研究に加え、PAC1受容体とPACAPそのものの遺伝子改変マウス(ノックアウトマウスなど)を作成するなど、遺伝子から個体に至る包括的な研究を実施しました。
PACAP遺伝子をノックアウトしたマウス(PACAP欠損マウス)は、新規環境での多動と衝動的なジャンピング(下の写真)、特異な情動の異常等を示し、PACAPが精神行動の調節に関わる脳内の分子であるという予測外の発見につながりました(2001 PNAS)。

また臨床機関との共同研究(橋本亮太博士ら)では、ヒトPACAP遺伝子の一塩基多型(SNP)が、統合失調症の発症リスクに関連する可能性を示す結果が得られました(Mol Psychiatry 2007)。
他方、末梢組織においては、膵臓でインスリンを分泌するβ細胞に特異的なPACAP過剰発現マウスを作製して解析し、PACAPがインスリン分泌を促進する作用のほかに、β細胞のturnoverに関与する可能性を見い出し(Diabetes 2003)、また生理的状態における血小板凝集への関与も示しました (J Clin Invest 2004)。
PACAPの発見から20余年が経過しましたが、当初の予想を超えてその重要性が認識され、研究がますます盛んに行われている状況です。私たちは、脳のとくに精神機能調節と、膵臓の長期的な機能調節に関して、遺伝子改変マウスを駆使した研究を行い、その意味ではPACAP研究で世界をリードしてきたものと思います。橋本も執筆に加わったPACAPに関する代表的なレビューも参考にしてください (Pharmacol Rev 2009)。
